分子と生命を繋ぐ
生体分子、細胞、組織、そして個体に至る生命システムは常に外界に晒(さら)されながら、ミクロレベルでの“刺激”がマクロレベルまで伝達し頑健な機能を作り出しています。生体系の反応現象の多くは、複雑ななかに特異性、すなわち、選択性・機能性を保有していて、その特異性が生命現象の豊かさの源泉となっています。そのような生体高分子系の持つ特殊な構造は如何にして創造されたのでしょうか?サイコロを振るように偶発的に出現したのでしょうか?仮にそうであったとしても、なぜ、その生体系のもつ特異性が次世代へ化学的相互作用を通じてほぼ確率1で継承され得るのでしょうか?
自然科学研究において革命的な発展をもたらすものは、多くの場合、新しい実験技術とその新しい実験事実に基づいた理論・概念の転回です。近年、1分子計測技術等の飛躍的な進展により、「観測」の在り方が大きな変貌を遂げ、サブミリ秒程度の時間分解能で、1分子レベルの大規模構造変形や細胞の分化の計時変化を直接観測することが可能になってきました。BoltzmannやGibbsの時代に、計算機 シミュレーションで分子集団の運動を「つぶさに」眺めることができたとすると、多くの研究者は力学系カオスの問題に遭遇し、エルゴード問題に辿りつけず統計力学の発展はなかったかもしれません。ある意味、一分子レベルでの観察実験は、生命システムの理論や概念が未成熟である時代にあっては、まだ開けてはいけない「パンドラの箱」であったのかもしれません。
現在、生命システムを理解するためのアプローチには、大別して、背後に存在する数理構造を提唱するトップダウン的構成論的手法と微視的な立場からマクロな現象の再現を試みるボトムアップ的還元論的手法が存在します。前者は研究者のイメージが先行し大胆な仮定や粗視化のために自然から乖離したモデルに陥る可能性が存在する一方で、後者は個々の微視的事象を枚挙するだけでシステム全体を捉えることは困難です。現象に照らし合わせつつ、分子描像を忘れずに、自然な形で生命システムの論理を構成するには、どのような展開が考えられるでしょうか?
これまで、タンパク質の全基本構造の1/3(約3000種)以上のタンパク質の構造及びその機能を解析する「蛋白質3000プロジェクト」やヒトのゲノムの全塩基配列を解析する「ヒトゲノムプロジェクト」など生命系を構成する分子情報を網羅探索する学術研究が推進されてきました。これらの流れはボトムアップ的還元論に基づく研究の典型例と言えます。しかし、熱揺らぎのなかで頑健に機能を発現する仕組みや未知の環境においても適応できる創発性を内在する生命システムの全体像を解き明かすためには、まったく新しい角度から見つめ直す必要があるのではないでしょうか?
細胞や組織などのさまざまな環境の中での生体分子の挙動が一分子レベルで”見えてしまっている”ということは、トップダウン的構成論的手法とボトムアップ的還元論の利点を残しながら、両者を橋渡しできる理論や概念を構築できる可能性を提示しています。生体機能とは「外界からの刺激に対する応答として始まる一連の構造変化とそれに伴う化学反応」であり、階層を越えた「状態変化」のつながりの産物です。時々刻々変動する(自由)エネルギー地形上の複数の谷と峠を越えていく反応過程を通して情報伝達が保持される仕組みは原理的にも未踏の未解決問題なのです。我々は、化学反応や生体分子の構造転移などの状態変化における「偶然と必然」、「統計性と選択性」、「部分と全体」 の基礎原理を解明するとともに、“トップダウン”と“ボトムアップ”の両アプローチを橋渡しする新しい概念や方法論を確立し、できるだけ自然現象に照らし合わせながら生命システムの階層性の論理を構成し、生命の中に積木細工(院生・研究員募集の頁参照)をこえる新しい概念を創出したいと日々夢見ながら研究しています。
- (化学反応や蛋白質の構造転移などの)状態変化における「偶然と必然」に関する基本原理
- 1分子時系列情報に立脚したトップダウン的構成論とボトムアップ的還元論を橋渡しする新しい生命システム解析理論の創出
- 隷属原理を越えた階層間の情報伝達と機能
- 複雑分子系における適応、頑健性および創発
- 植物器官の再生的形態形成に潜む多様性と不均一性の定量化
化学反応や生体分子の構造転移における選択性と統計性の基本原理
- 物性研究(2001)の総説原稿
- 第43回分子科学若手の会 夏の学校(2003)の予稿
- ある雑誌に投稿して4ヶ月の審査の末に落された原稿(1999)
- その雑誌から要求されて執筆したAppendix(1999)
- 第3版集中講義ノート(東大2003、茨城大2004、広島大2006)
- 遊星人(2007)の解説原稿
- ある雑誌に投稿して8か月の審査の末落とされた原稿(2009.1.31-9.10)[SI]
たんぱく質フォールディングにおけるダイナミックス
- 物性研究(2002)の笹井、戸田氏との書簡原稿
- 生物物理(2002)の解説原稿
- 高分子 57(2),58-61 (2008)
一分子生物学:1分子時系列情報から生体分子機能の複雑さを解読する
- 第46回生物物理若手の会 夏の学校予稿(2006)
- 生物物理 のトピックス原稿(2008)
- たんぱく質の折り畳み運動を読み解く新手法を開発(JSTのプレリリース)(2007)
- 物性研究(2008)の原稿
植物器官の再生的形態形成に潜む多様性と不均一性の定量化
植物はどのようにして再生的な器官(葉や花びら)を形成するのでしょうか?この問いが長く植物発生学者を魅了し続けているのは、再生的で恒常的な器官レベルに対してミクロな細胞レベルでは多様性や不均一性が存在するからです。例えば、様々な植物種の観測から植物の多様な器官(葉、根、茎、花びら、がく片)において細胞レベルでのサイズや形状などの空間的多様性が観測されていて、近年ではさらに細胞の成長や分裂のタイミングなどの時間的不均一性といった驚くべき事実も報告されています。この細胞レベルでの多様性やゆらぎの中で、植物はどのように協調(または競合)して最終的な形状を獲得しているのでしょうか。
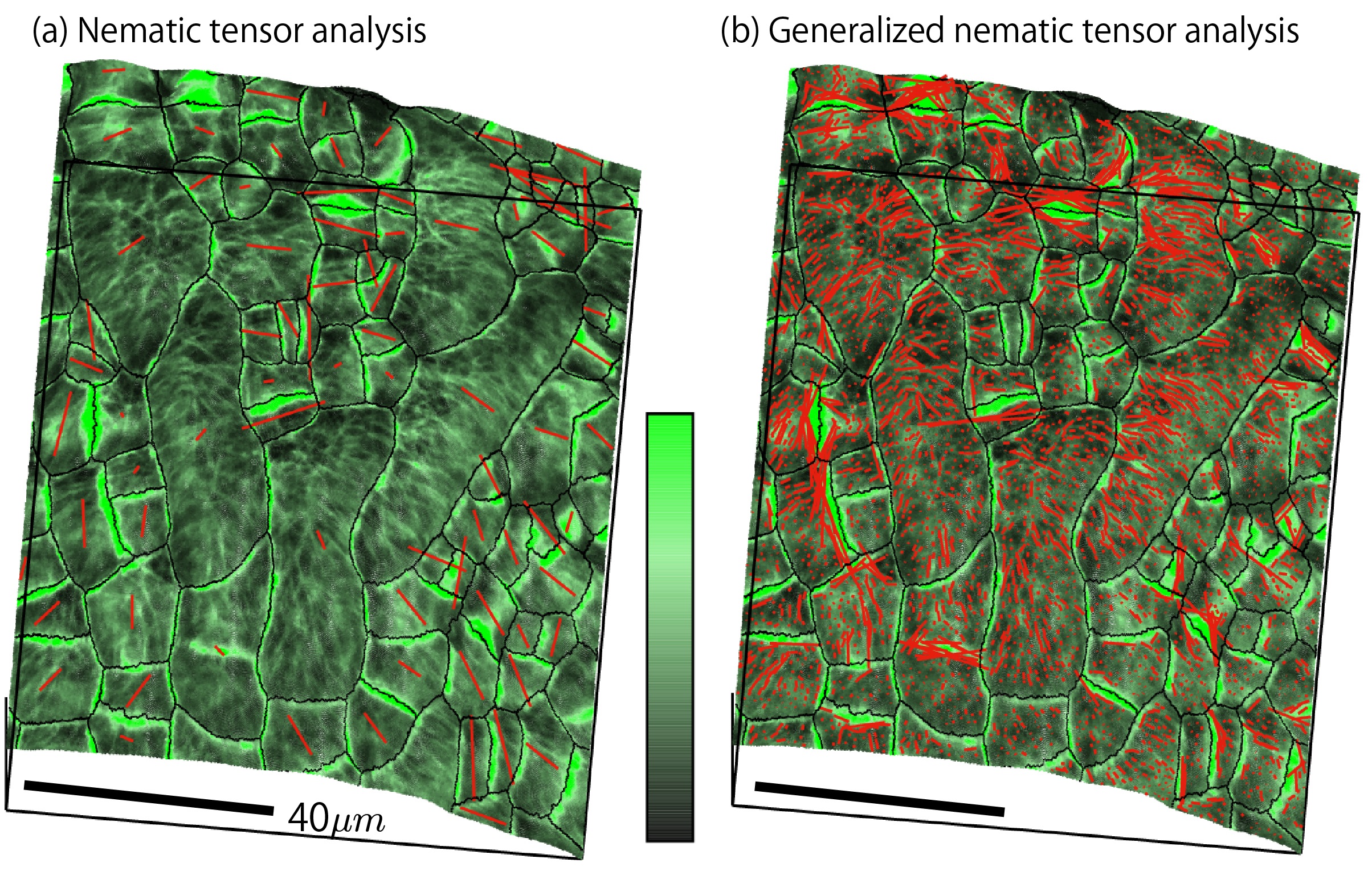
この問題の解決へ向けての最近の進展として、細胞の形状と機能による相補的なフィードバック機構という概念が注目を集めています。植物細胞の例でいえば、細胞壁の形状に由来する応力構造にしたがって細胞内の微小管の配向方向が決められていて、さらにはその微小管配向に由来するセルロース配向方向によって次なる細胞の成長方向(形状)が決められる、といった具合に形態形成の背後に潜むフィードバックメカニズムが徐々に明らかにされてきています。また、ライブイメージング技術などの観測技術や3次元可視化ソフトウェアなどの可視化技術も開発、発展してきており、細胞レベルよりもさらに微細な分子レベルにおける微小管や細胞膜の蛍光データを観測できるようになってきています。
我々のグループでは、分子レベルのダイナミクスから細胞レベルの構造特性(サイズ、成長率)へ、さらには細胞レベルの平均的振る舞いから器官レベルでの形態形成(最終サイズ、成長停止時間)へと至るメカニズムの解明を目指して、観測データ(微小管蛍光画像、細胞サイズ分布など)から従来定量することが困難であった細胞レベルあるいは分子レベルでの多様性、不均一性の定量化方法を探求しています。最近の研究成果では、下図に示すように従来手法による細胞単位での微小管配向の定量化(左)から局所領域のサンプリング誤差を利用することでより局所的な微小管配向の定量化(右)に拡張することができ、細胞内の分子レベルでの不均一性を誤差付きで定量化することが可能になりました。